QUÍMICA Y SOCIEDAD.
jueves, 15 de diciembre de 2016
sábado, 10 de diciembre de 2016
QUÍMICA DEL CARBONO
QUÍMICA DEL CARBONO
Introducción→ La química orgánica es la rama de la química que estudia una clase numerosa de moléculas que en su gran mayoría contienen carbono formando enlaces covalentes carbono-carbono o carbono-hidrógeno y otros heteroátomos, también conocidos como compuestos orgánicos. Debido a la omnipresencia del carbono en los compuestos que esta rama de la química estudia esta disciplina también es llamada química del carbono.
1- Explica los motivos por los que el carbono es el elemento que forma mayor número de compuestos.
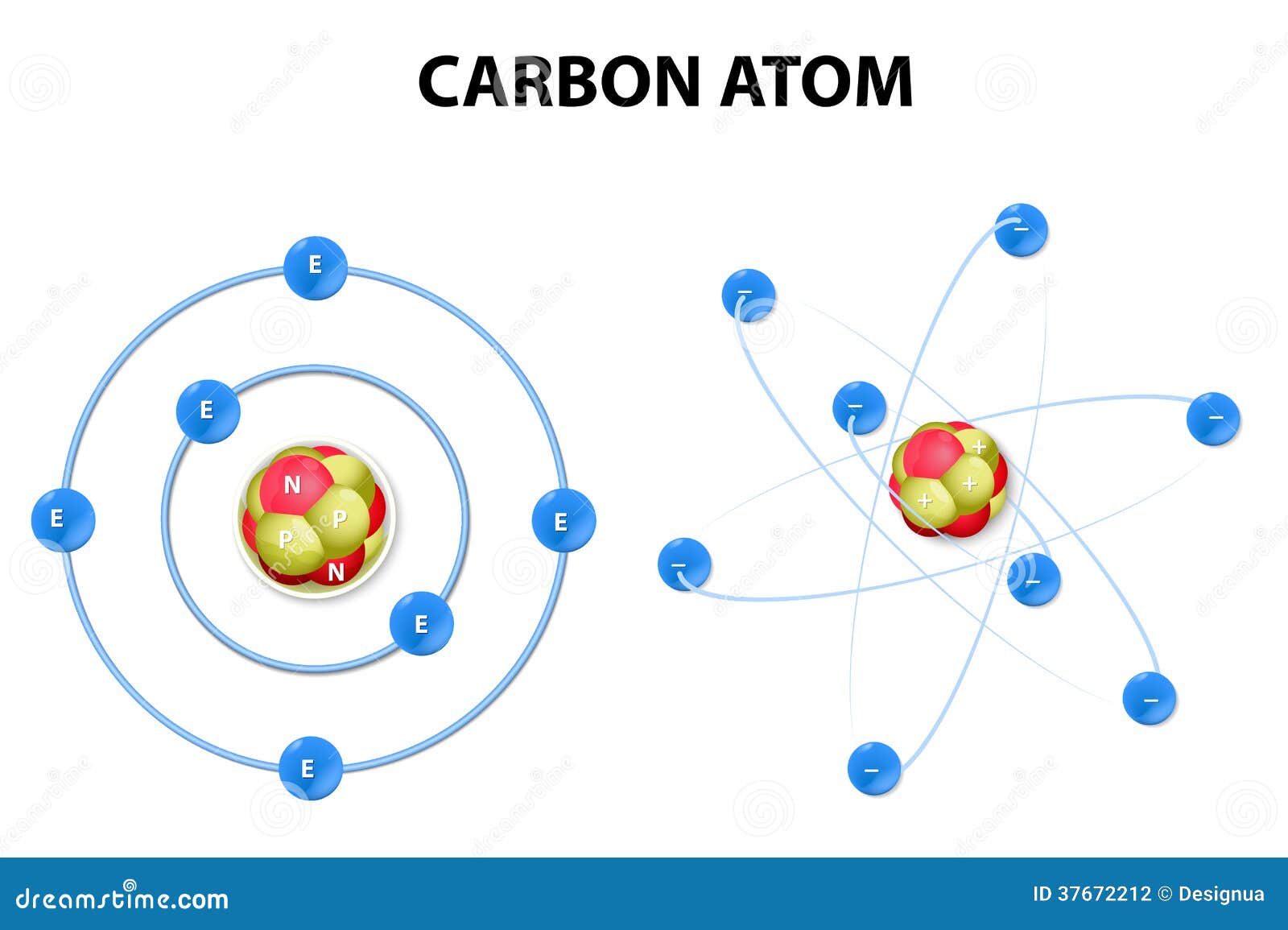
El carbono es un elemento químico fundamental en los seres vivos. Su número atómico es 6 y su número másico es 12. En la naturaleza se presenta en forma de grafito y de diamante. Su valencia o capacidad de combinación es 4, es decir, tetravalente. Esta capacidad de combinación la presenta también con otros átomos de carbono, lo que da lugar a las cadenas carbonadas. Estos enlaces carbono-carbono de carácter covalente pueden dar lugar a moléculas con cadenas abiertas o cerradas, con sus correspondientes ramificaciones.
En resolución,el carbono es el elemento que forma mayor número de compuesto, debido a que los átomos de carbono tienen la capacidad de formar enlaces carbono-carbono en forma simple, doble y triple, y también pueden formar cadenas y estructuras cíclicas. Los cuatro electrones en su capa externa posee números de oxidación que van de 4+ a 4–, y forma enlaces predominantemente covalentes. Las reacciones entre dos átomos no metales producen enlaces covalentes. Este tipo de enlace se produce cuando existe electronegatividad polar y se forma cuando la diferencia de electronegatividad no es suficientemente grande como para que se efectúe la transferencia de electrones. De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular.
2- Analiza las distintas formas alotrópicas del carbono, relacionando la estructura con las propiedades.
Su gran posibilidad de combinación permite encontrar el carbono en seis formas alotrópicas diferentes, aunque el número puede continuar incrementándose.
Para entenderlo, debemos recurrir a la configuración electrónica. El carbono es un 2s2 2p2, por lo que posee cuatro electrones de valencia. Para cumplir el octeto podría formar enlaces iónicos ganando o perdiendo electrones, pero requiere demasiada energía.
Curiosidad: el término alotrópico proviene de alo- y de tropos, que en griego significa "mutación".De esta manera, alotrópicos son las diferentes formas en la que se puede transformar o encontrar una sustancia.
Diamante→ Es un alótropo del carbono donde los átomos de carbono están dispuestos en una variante de la estructura cristalina cúbica centrada en la cara denominada «red de diamante».
Es sólido y muy duro con elevadísima temperatura de fusión.
Estructura constituida por carbono con cuatro enlaces en disposición tetraédrica.
Carbono cristalino, de transparente a opaco, ópticamente isótropo. Es el material natural más duro conocido, gracias a su enlace covalente, aunque su tenacidad no es tan buena debido a importantes defectos estructurales.
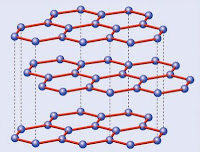
Grafito→ Estructura constituida por carbono con tres enlaces en disposición triangular plana.Es buen conductor de la electricidad y muy grasoso.
Es el alótropo de carbón más estable, está formado por un extenso sistema políciclico de anillos bencénicos fusionados que se disponen en capas, separadas entre sí 3,35 A. El carácter completamente deslocalizado de estas láminas, formadas únicamente por la unión de carbonos sp2, es el origen del color negro y de la conductividad del grafito. Además, como estas láminas pueden desplazarse lateralmente, el grafito tiene propiedades lubricantes. También se emplea en las minas de los lápices.

Grafeno→ Estructura plana similar a una única capa de grafito pero que le dota de unas propiedades insospechadamente diferentes.
Es doscientas veces más duro que el diamante y más resistente que el acero,posee una conductividad eléctrica y térmica muy alta,semejante a un metal, pero con la ventaja de que es mucho más ligero y flexible.
Curiosidad: descubierto en 2004 y con Nobel en 2010, el grafeno es uno de los materiales con mayor futuro.
Fullerenos o fulerenos→ Estructuras formadas por una malla de anillos hexagonales de carbono, pudiendo formar estructuras cerradas(buckyesferas) o abiertas (buckytubos).Podemos considerar que provienen de una capa de grafeno plegada sobre sí misma.
⇰ Buckyesferas→ La malla de anillos se cierra sobre sí misma, pudiendo intercalar anillos pentagonales para mayor flexibilidad.
En fase sólida se ordena en una forma cristalina semejante a un metal gracias a fuerzas de Van der Waals,formando un hollín.Bajo esta forma se desplazan entre ellas, por lo que es un buen lubricante.Por su tamaño, sirve para capturar y/o transportar moléculas.
⇰ Buckytubos o nanotubos de carbono→La malla se cierra lateralmente, formando un cilindro de radio nanométrico, entre diez y cincuenta mil veces más delgado que un cabello.
Es veinte veces más resistente a la tensión del acero y con la mitad de densidad que el aluminio, son excelentes conductores eléctricos y térmicos a lo largo del tubo.
Serían nuestros cables del futuro.
Otras estructuras novedosas→Por ejemplo:
- Carbino→Cadenas infinitas de carbono con la secuencia alterna de simple y triple enlace.Hasta hace poco únicamente se detectaban en el espacio exterior, siendo el material más duro conocido.

- Nanoespumas→Donde se combinan hexágonos y heptágonos de carbono originando, al contrario que los fullerenos, estructuras con curvatura inversa poco densas.
- Aerogel de nanotubos de carbono→Hasta 2015, el material más ligero que se conoce.
3- Describe las aplicaciones de hidrocaburos sencillos de especial interés.
Definición: los hidrocarburos son una fuente importante de
generación de energía para nuestros hogares, industrias y
el desarrollo de la vida cotidiana. No es sólo un combustible,
sino que a través de procesos más avanzados se separan
sus elementos y se logra su aprovechamiento a través de la
industria petroquímica.
Atendiendo a la naturaleza de los enlaces, pueden clasificarse de la siguiente forma:
ALQUENOS.
Definición: son hidrocarburos insaturados que tienen uno o varios enlaces carbono- carbono en su molécula.
- El uso más importante de los alquenos es como materia prima para la elaboración de plásticos.
- El alqueno de mayor uso industrial sea el etileno (eteno) que se utiliza entre otras cosas para obtener el plástico polietileno, de gran uso en cañerías, envases, bolsas y aislantes eléctricos. También se utiliza para obtener alcohol etílico, etilen-glicol, cloruro de vinilo y estireno.
- El propileno (propeno) es materia prima del propileno, usado en la industria textil y para fabricar tubos y cuerdas.
ALCANOS.
Definición: son hidrocarburos, es decir, compuestos que sólo contienen átomos de carbono e hidrocarbono.
- El metano y el etano forman parte del gas natural, que es usado como combustible pricipalmente para calefacción y cocinas.
- El propano y el butano tienen el mismo uso que el gas natural, pero su suministro no es canalizado, sino mediante depósitos o bombonas.
- Desde el pentano hasta el octano los alcanos son líquidos volátiles. Se usan como combustibles en motores de combustión interna, pues forman parte de la gasolina.
- Los hidrocarburos de 9 a 16 átomos de carbono son líquidos de alta viscosidad y forman parte del diésel y combustible de aviones.
- Los alcanos a partir del hexadecano en adelante constituyen los componentes más importantes de los aceites lubricantes.
Definición:son hidrocarburos que contienen enlaces triples entre dos átomos de carbono.
- El alquino de mayor uso es el acetileno, que es un combustible de alto rendimiento, utilizado en las aplicaciones oxiacetilénicas.
- A partir de él también se sintetizan gran cantidad de compuestos orgánicos, siendo el ácido acético uno de los más importantes junto a otros hidrocarburos insaturados capaces de polimerizarse dando plásticos y caucho.
Mediante la aplicación de distintos procesos de transformación (refinación) de los hidrocarburos, se pone a disposición del consumidor una amplia gama de productos que podemos agrupar en:
⇒ Energéticos: son específicos para el transporte, al industria, la agricultura, la -generación de corriente eléctrica y uso doméstico.
· ⇒Productos especiales: como lubricantes, asfaltos, grasas para vehículos y productos de uso industrial.
La industria petroquímica hace uso de los elementos que
se encuentran presentes en los hidrocarburos produciendo
compuestos más elaborados que sirvan de materia prima
para las demás industrias. Como hoy en día son los
plásticos, nylon, fibras sintéticas, pinturas, diversos
envases, detergentes, cosméticos, insecticidas, adhesivos,
colorantes…
Suscribirse a:
Comentarios (Atom)
