¿Qué son las fuerzas intermoleculares?
Las fuerzas intermoleculares se definen como el conjunto de fuerzas atractivas y repulsivas que se producen entre las moléculas como consecuencia de la polaridad que poseen las moléculas.
Cuando dos o más átomos se unen mediante un enlace químico forman una molécula, los electrones que conforman la nueva molécula recorren y se concentran en la zona del átomo con mayor electronegatividad, definimos la electronegatividad como la propiedad que tienen los átomos en atraer electrones. La concentración de los electrones en una zona definida de la molécula crea una carga negativa, mientras que la ausencia de los electrones crea una carga positiva.
¿Qué es un dipolo?
Denominamos dipolos a las moléculas que disponen de zonas cargadas negativamente y positivamente debido a la electronegatividad y concentración de los electrones en las moléculas.
Podemos asimilar el funcionamiento de un dipolo a un imán con su polo positivo y su polo negativo, de tal forma que si acercamos otro imán el polo positivo atraerá al polo negativo y viceversa, dando como resultado una unión.
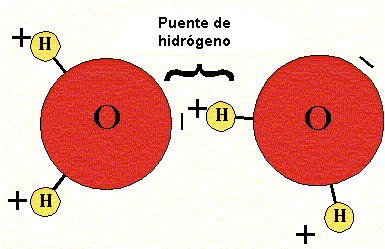
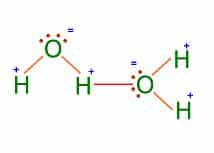
➽ Puentes de hidrógeno ⇾ Son una clase de enlace que se produce a partir de la atracción existente en un átomo de hidrógeno y un átomo de oxígeno, flúor o nitrógeno con carga negativa.Dicha atracción se conoce como interacción de dipolo- dipolo y vincula el polo positivo de una molécula con el polo negativo de la otra.
Los puentes de hidrógeno también aparecen en el ADN, el agua y las proteínas. Debido a su existencia, se producen fenómenos de gran importancia, que incluso pueden aparecer de forma cotidiana. El punto de ebullición del agua, la menor densidad del hielo respecto al agua líquida y la consistencia de la glicerina están vinculados a la presencia de puentes de hidrógeno en las moléculas.
Por ejemplo el agua, es una de las substancias que presenta este tipo de enlaces entre sus moléculas. Una molécula de agua se forma entre un átomo de Oxígeno con seis electrones de valencia (sólo comparte dos y le quedan dos pares de electrones libres) y dos hidrógenos con un electrón de valencia cada uno (ambos le ceden su único electrón al oxígeno para que complete el octeto).
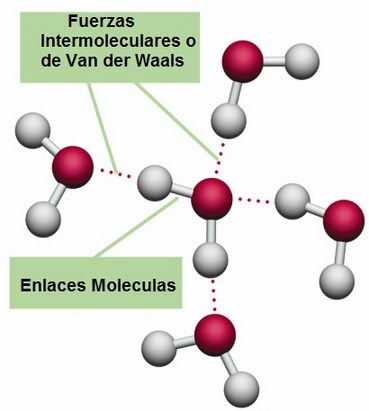
➽ Fuerzas de Van Der Waals⇾ Fueron nombradas en honor al físico neerlandés Johannes Diderik van der Waals (1837-1923), premio Nobel de Física en 1910, que en 1873 fue el primero en introducir sus efectos en las ecuaciones de estado de un gas.
Estas fuerzas son las responsables de muchos fenómenos físicos y químicos como la adhesión, rozamiento, difusión, tensión superficial y la viscosidad.Son fuerzas más débiles que las internas que unen la molécula ya que dependen exclusivamente del tamaño y forma de la molécula pudiendo ser de atracción o de repulsión. Son tan débiles que no se las puede considerar un enlace, como el enlace covalente o iónico, solo se las considera una atracción.
Las fuerzas de Van Der Waals se pueden clasificar en:
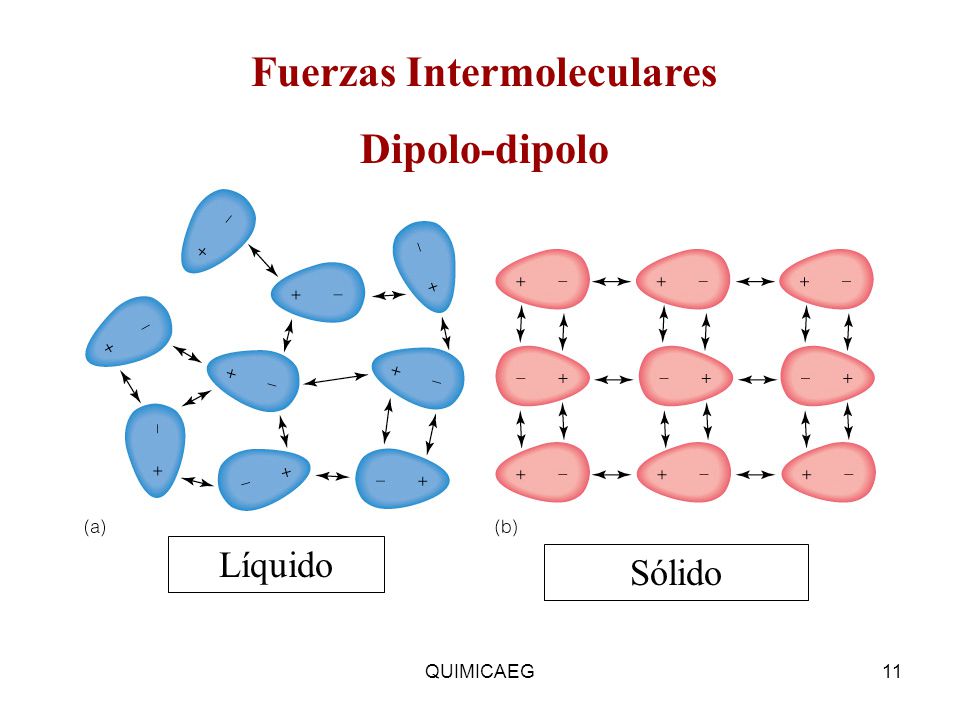
➽Dipolo- dipolo⇾ Es la observada entre un dipolo positivo de una molécula polar con el dipolo negativo de otra. En los enlaces covalentes polares, el átomo con mayor electronegatividad atrae los electrones hacia sí, formándose un dipolo negativo en torno al mismo. En el átomo con menor electronegatividad, el dipolo formado es de carga positiva, ya que cede parcialmente sus electrones. Las atracciones electrostáticas entre dipolos de carga contraria, de diferentes moléculas son las llamadas interacciones dipolo-dipolo.
➽Ión- dipolo⇾ Los iones de una sustancia pueden interactuar con los polos de las moléculas covalentes polares. Así, el polo negativo de una molécula atrae al ion positivo y el polo positivo interactúa con el ion negativo: las partes de cada molécula se unen por fuerzas de atracción de cargas opuestas. Ejemplo de este tipo de interacción se produce en la solvatación de una solución acuosa de cloruro de sodio (NaCl). También se produce en la solvatación acuosa de H2O y como también hay muchas, como por ejemplo, el cobre entre otros metales.
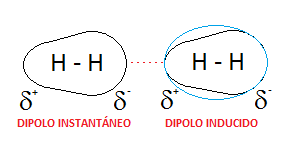
➽Dipolio instantáneo- dipolo incluido⇾ En las moléculas no polares puede producirse transitoriamente un desplazamiento relativo de los electrones, originando un polo positivo y otro negativo que determinan una atracción entre dichas moléculas.
➽Dipolo- dipolo incluido⇾Una molécula polar(dipolo),al estar próxima a otra no polar,introduce en ésta un dipolo transitorio,produciendo una fuerza de atracción intermolecular.
Estos son algunos de los ejemplos de las sustancias biológicas que se encuentran en las fuerzas intermoleculares:
➽ Dióxido de carbono(CO2)⇾ Fuerza de Van Der Waals.
➽ Agua (H2O)⇾ Puente de hidrógeno.
➽ Nitrógeno(N2)⇾ Van Der Waasl.
➽ Amoniáco( NH3)⇾ Puente de hidrógeno.