QUÍMICA Y SOCIEDAD.
jueves, 15 de diciembre de 2016
sábado, 10 de diciembre de 2016
QUÍMICA DEL CARBONO
QUÍMICA DEL CARBONO
Introducción→ La química orgánica es la rama de la química que estudia una clase numerosa de moléculas que en su gran mayoría contienen carbono formando enlaces covalentes carbono-carbono o carbono-hidrógeno y otros heteroátomos, también conocidos como compuestos orgánicos. Debido a la omnipresencia del carbono en los compuestos que esta rama de la química estudia esta disciplina también es llamada química del carbono.
1- Explica los motivos por los que el carbono es el elemento que forma mayor número de compuestos.
El carbono es un elemento químico fundamental en los seres vivos. Su número atómico es 6 y su número másico es 12. En la naturaleza se presenta en forma de grafito y de diamante. Su valencia o capacidad de combinación es 4, es decir, tetravalente. Esta capacidad de combinación la presenta también con otros átomos de carbono, lo que da lugar a las cadenas carbonadas. Estos enlaces carbono-carbono de carácter covalente pueden dar lugar a moléculas con cadenas abiertas o cerradas, con sus correspondientes ramificaciones.
En resolución,el carbono es el elemento que forma mayor número de compuesto, debido a que los átomos de carbono tienen la capacidad de formar enlaces carbono-carbono en forma simple, doble y triple, y también pueden formar cadenas y estructuras cíclicas. Los cuatro electrones en su capa externa posee números de oxidación que van de 4+ a 4–, y forma enlaces predominantemente covalentes. Las reacciones entre dos átomos no metales producen enlaces covalentes. Este tipo de enlace se produce cuando existe electronegatividad polar y se forma cuando la diferencia de electronegatividad no es suficientemente grande como para que se efectúe la transferencia de electrones. De esta forma, los dos átomos comparten uno o más pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular.
2- Analiza las distintas formas alotrópicas del carbono, relacionando la estructura con las propiedades.
Su gran posibilidad de combinación permite encontrar el carbono en seis formas alotrópicas diferentes, aunque el número puede continuar incrementándose.
Para entenderlo, debemos recurrir a la configuración electrónica. El carbono es un 2s2 2p2, por lo que posee cuatro electrones de valencia. Para cumplir el octeto podría formar enlaces iónicos ganando o perdiendo electrones, pero requiere demasiada energía.
Curiosidad: el término alotrópico proviene de alo- y de tropos, que en griego significa "mutación".De esta manera, alotrópicos son las diferentes formas en la que se puede transformar o encontrar una sustancia.
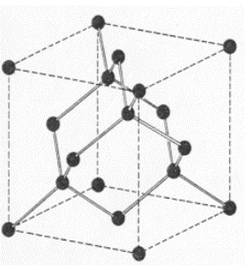
Diamante→ Es un alótropo del carbono donde los átomos de carbono están dispuestos en una variante de la estructura cristalina cúbica centrada en la cara denominada «red de diamante».
Es sólido y muy duro con elevadísima temperatura de fusión.
Estructura constituida por carbono con cuatro enlaces en disposición tetraédrica.
Carbono cristalino, de transparente a opaco, ópticamente isótropo. Es el material natural más duro conocido, gracias a su enlace covalente, aunque su tenacidad no es tan buena debido a importantes defectos estructurales.

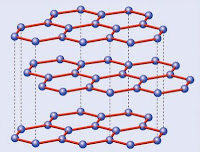
Grafito→ Estructura constituida por carbono con tres enlaces en disposición triangular plana.Es buen conductor de la electricidad y muy grasoso.
Es el alótropo de carbón más estable, está formado por un extenso sistema políciclico de anillos bencénicos fusionados que se disponen en capas, separadas entre sí 3,35 A. El carácter completamente deslocalizado de estas láminas, formadas únicamente por la unión de carbonos sp2, es el origen del color negro y de la conductividad del grafito. Además, como estas láminas pueden desplazarse lateralmente, el grafito tiene propiedades lubricantes. También se emplea en las minas de los lápices.

Grafeno→ Estructura plana similar a una única capa de grafito pero que le dota de unas propiedades insospechadamente diferentes.
Es doscientas veces más duro que el diamante y más resistente que el acero,posee una conductividad eléctrica y térmica muy alta,semejante a un metal, pero con la ventaja de que es mucho más ligero y flexible.
Curiosidad: descubierto en 2004 y con Nobel en 2010, el grafeno es uno de los materiales con mayor futuro.

Fullerenos o fulerenos→ Estructuras formadas por una malla de anillos hexagonales de carbono, pudiendo formar estructuras cerradas(buckyesferas) o abiertas (buckytubos).Podemos considerar que provienen de una capa de grafeno plegada sobre sí misma.
⇰ Buckyesferas→ La malla de anillos se cierra sobre sí misma, pudiendo intercalar anillos pentagonales para mayor flexibilidad.
En fase sólida se ordena en una forma cristalina semejante a un metal gracias a fuerzas de Van der Waals,formando un hollín.Bajo esta forma se desplazan entre ellas, por lo que es un buen lubricante.Por su tamaño, sirve para capturar y/o transportar moléculas.
⇰ Buckytubos o nanotubos de carbono→La malla se cierra lateralmente, formando un cilindro de radio nanométrico, entre diez y cincuenta mil veces más delgado que un cabello.
Es veinte veces más resistente a la tensión del acero y con la mitad de densidad que el aluminio, son excelentes conductores eléctricos y térmicos a lo largo del tubo.
Serían nuestros cables del futuro.
Otras estructuras novedosas→Por ejemplo:
- Carbino→Cadenas infinitas de carbono con la secuencia alterna de simple y triple enlace.Hasta hace poco únicamente se detectaban en el espacio exterior, siendo el material más duro conocido.

- Nanoespumas→Donde se combinan hexágonos y heptágonos de carbono originando, al contrario que los fullerenos, estructuras con curvatura inversa poco densas.

- Aerogel de nanotubos de carbono→Hasta 2015, el material más ligero que se conoce.

3- Describe las aplicaciones de hidrocaburos sencillos de especial interés.
Definición: los hidrocarburos son una fuente importante de
generación de energía para nuestros hogares, industrias y
el desarrollo de la vida cotidiana. No es sólo un combustible,
sino que a través de procesos más avanzados se separan
sus elementos y se logra su aprovechamiento a través de la
industria petroquímica.
Atendiendo a la naturaleza de los enlaces, pueden clasificarse de la siguiente forma:
ALQUENOS.
Definición: son hidrocarburos insaturados que tienen uno o varios enlaces carbono- carbono en su molécula.
- El uso más importante de los alquenos es como materia prima para la elaboración de plásticos.
- El alqueno de mayor uso industrial sea el etileno (eteno) que se utiliza entre otras cosas para obtener el plástico polietileno, de gran uso en cañerías, envases, bolsas y aislantes eléctricos. También se utiliza para obtener alcohol etílico, etilen-glicol, cloruro de vinilo y estireno.
- El propileno (propeno) es materia prima del propileno, usado en la industria textil y para fabricar tubos y cuerdas.
ALCANOS.
Definición: son hidrocarburos, es decir, compuestos que sólo contienen átomos de carbono e hidrocarbono.
- El metano y el etano forman parte del gas natural, que es usado como combustible pricipalmente para calefacción y cocinas.
- El propano y el butano tienen el mismo uso que el gas natural, pero su suministro no es canalizado, sino mediante depósitos o bombonas.
- Desde el pentano hasta el octano los alcanos son líquidos volátiles. Se usan como combustibles en motores de combustión interna, pues forman parte de la gasolina.
- Los hidrocarburos de 9 a 16 átomos de carbono son líquidos de alta viscosidad y forman parte del diésel y combustible de aviones.
- Los alcanos a partir del hexadecano en adelante constituyen los componentes más importantes de los aceites lubricantes.
Definición:son hidrocarburos que contienen enlaces triples entre dos átomos de carbono.
- El alquino de mayor uso es el acetileno, que es un combustible de alto rendimiento, utilizado en las aplicaciones oxiacetilénicas.
- A partir de él también se sintetizan gran cantidad de compuestos orgánicos, siendo el ácido acético uno de los más importantes junto a otros hidrocarburos insaturados capaces de polimerizarse dando plásticos y caucho.
Mediante la aplicación de distintos procesos de transformación (refinación) de los hidrocarburos, se pone a disposición del consumidor una amplia gama de productos que podemos agrupar en:
⇒ Energéticos: son específicos para el transporte, al industria, la agricultura, la -generación de corriente eléctrica y uso doméstico.
· ⇒Productos especiales: como lubricantes, asfaltos, grasas para vehículos y productos de uso industrial.
La industria petroquímica hace uso de los elementos que
se encuentran presentes en los hidrocarburos produciendo
compuestos más elaborados que sirvan de materia prima
para las demás industrias. Como hoy en día son los
plásticos, nylon, fibras sintéticas, pinturas, diversos
envases, detergentes, cosméticos, insecticidas, adhesivos,
colorantes…
jueves, 17 de noviembre de 2016
ACTIVIDADES SOBRE LAS FUERZAS INTERMOLECULARES
ACTIVIDADES SOBRE LAS FUERZAS INTERMOLECULARES
Actividad 1: observa la gráfica pequeña de la página 54 del libro y explica por qué el agua tiene esos puntos de fusión y ebullición tan elevadas(que no le correspondían), y qué importancia tiene esto para tu vida.
¿En qué consisten la fusión y la ebullición?
Fusión→ La fusión consiste en el cambio de estado de la materia del estado sólido al estado líquido por la acción del calor.
En el agua, la fusión comienza a los 273 grados Kelvin, que son aproximadamente 0ºC.
Ebullición→ Proceso físico en el cual un líquido pasa a estado gaseoso.
La ebullición comienza a los 375 grados Kelvin, que son aproximadamente 100ºC.
Esos puntos tan altos son debidos a los puentes de hidrógeno. La temperatura media en la Tierra son de unos 15ºC, por lo cual teniendo en cuenta la temperatura de fusión y de ebullición del agua, por lo cual el agua está a esa temperatura en estado líquido.
La importancia de este suceso en nuestra vida, es que si no fuese así no existiría la vida, ya que el 70% de nuestro cuerpo está compuesto por agua.

Página 67
Ejercicio 24 Justifica la evolución de las temperaturas de fusión de los haluros de hidrógeno:
La evolución consiste en que el fluoruro de hidrógeno(HF) tiene las temperaturas más altas de fusión y ebullición.
Este fenómeno se debe a los puentes de hidrógeno, ya que cuesta romperlos para pasar de un estado a a otro, por lo cual los puentes de hidrógeno de ese componente son más fuertes que los demás.
El flúor es un elemento con mucha carga electromagnética, por ello atrae mayor número de moléculas y crea puentes más fuertes. La molécula de HF es mucho más polar y magnética que los demás haluros de hidrógeno.
lunes, 14 de noviembre de 2016
LAS FUERZAS INTERMOLECULARES EN LA VIDA
¿Qué son las fuerzas intermoleculares?
Las fuerzas intermoleculares se definen como el conjunto de fuerzas atractivas y repulsivas que se producen entre las moléculas como consecuencia de la polaridad que poseen las moléculas.
Cuando dos o más átomos se unen mediante un enlace químico forman una molécula, los electrones que conforman la nueva molécula recorren y se concentran en la zona del átomo con mayor electronegatividad, definimos la electronegatividad como la propiedad que tienen los átomos en atraer electrones. La concentración de los electrones en una zona definida de la molécula crea una carga negativa, mientras que la ausencia de los electrones crea una carga positiva.
¿Qué es un dipolo?
Denominamos dipolos a las moléculas que disponen de zonas cargadas negativamente y positivamente debido a la electronegatividad y concentración de los electrones en las moléculas.
Podemos asimilar el funcionamiento de un dipolo a un imán con su polo positivo y su polo negativo, de tal forma que si acercamos otro imán el polo positivo atraerá al polo negativo y viceversa, dando como resultado una unión.

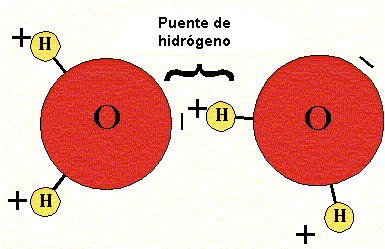
➽ Puentes de hidrógeno ⇾ Son una clase de enlace que se produce a partir de la atracción existente en un átomo de hidrógeno y un átomo de oxígeno, flúor o nitrógeno con carga negativa.Dicha atracción se conoce como interacción de dipolo- dipolo y vincula el polo positivo de una molécula con el polo negativo de la otra.
Los puentes de hidrógeno también aparecen en el ADN, el agua y las proteínas. Debido a su existencia, se producen fenómenos de gran importancia, que incluso pueden aparecer de forma cotidiana. El punto de ebullición del agua, la menor densidad del hielo respecto al agua líquida y la consistencia de la glicerina están vinculados a la presencia de puentes de hidrógeno en las moléculas.
Por ejemplo el agua, es una de las substancias que presenta este tipo de enlaces entre sus moléculas. Una molécula de agua se forma entre un átomo de Oxígeno con seis electrones de valencia (sólo comparte dos y le quedan dos pares de electrones libres) y dos hidrógenos con un electrón de valencia cada uno (ambos le ceden su único electrón al oxígeno para que complete el octeto).
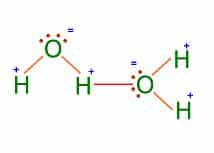

➽ Fuerzas de Van Der Waals⇾ Fueron nombradas en honor al físico neerlandés Johannes Diderik van der Waals (1837-1923), premio Nobel de Física en 1910, que en 1873 fue el primero en introducir sus efectos en las ecuaciones de estado de un gas.
Estas fuerzas son las responsables de muchos fenómenos físicos y químicos como la adhesión, rozamiento, difusión, tensión superficial y la viscosidad.Son fuerzas más débiles que las internas que unen la molécula ya que dependen exclusivamente del tamaño y forma de la molécula pudiendo ser de atracción o de repulsión. Son tan débiles que no se las puede considerar un enlace, como el enlace covalente o iónico, solo se las considera una atracción.
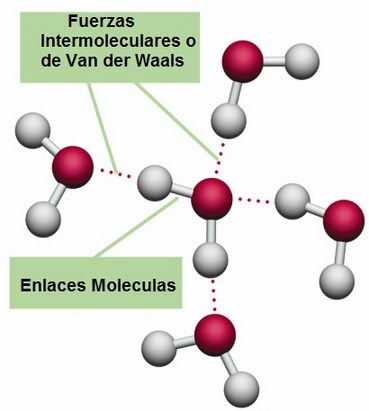

Las fuerzas de Van Der Waals se pueden clasificar en:
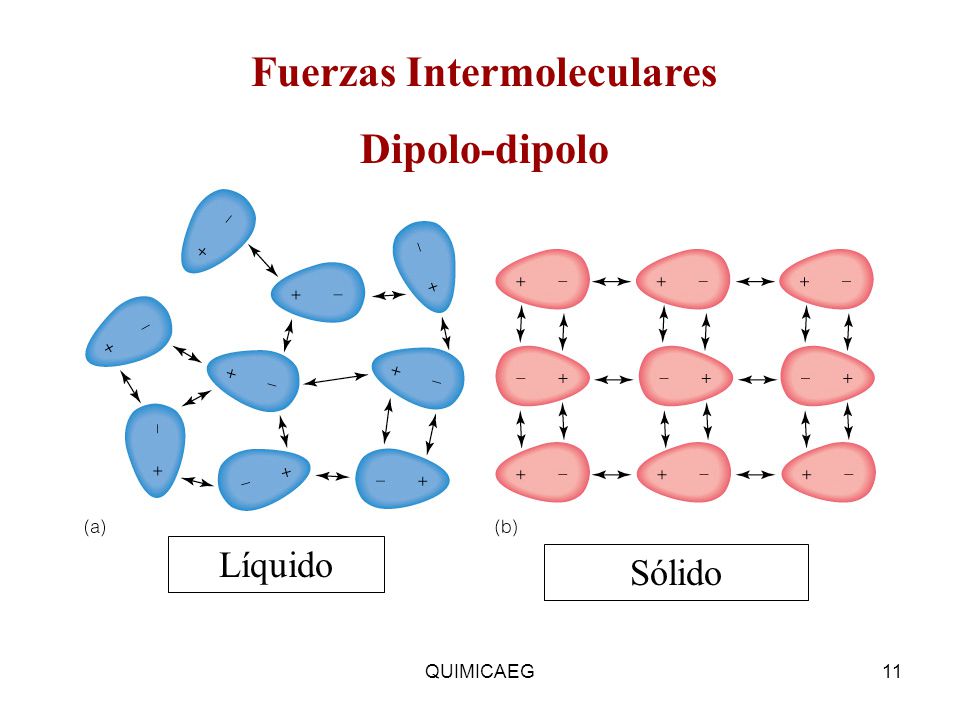
➽Dipolo- dipolo⇾ Es la observada entre un dipolo positivo de una molécula polar con el dipolo negativo de otra. En los enlaces covalentes polares, el átomo con mayor electronegatividad atrae los electrones hacia sí, formándose un dipolo negativo en torno al mismo. En el átomo con menor electronegatividad, el dipolo formado es de carga positiva, ya que cede parcialmente sus electrones. Las atracciones electrostáticas entre dipolos de carga contraria, de diferentes moléculas son las llamadas interacciones dipolo-dipolo.
➽Ión- dipolo⇾ Los iones de una sustancia pueden interactuar con los polos de las moléculas covalentes polares. Así, el polo negativo de una molécula atrae al ion positivo y el polo positivo interactúa con el ion negativo: las partes de cada molécula se unen por fuerzas de atracción de cargas opuestas. Ejemplo de este tipo de interacción se produce en la solvatación de una solución acuosa de cloruro de sodio (NaCl). También se produce en la solvatación acuosa de H2O y como también hay muchas, como por ejemplo, el cobre entre otros metales.

➽Dipolio instantáneo- dipolo incluido⇾ En las moléculas no polares puede producirse transitoriamente un desplazamiento relativo de los electrones, originando un polo positivo y otro negativo que determinan una atracción entre dichas moléculas.
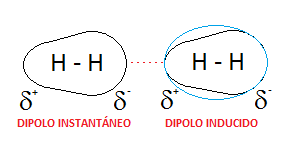
➽Dipolo- dipolo incluido⇾Una molécula polar(dipolo),al estar próxima a otra no polar,introduce en ésta un dipolo transitorio,produciendo una fuerza de atracción intermolecular.
Estos son algunos de los ejemplos de las sustancias biológicas que se encuentran en las fuerzas intermoleculares:
➽ Agua (H2O)⇾ Puente de hidrógeno.
➽ Nitrógeno(N2)⇾ Van Der Waasl.
➽ Amoniáco( NH3)⇾ Puente de hidrógeno.
martes, 1 de noviembre de 2016
jueves, 20 de octubre de 2016
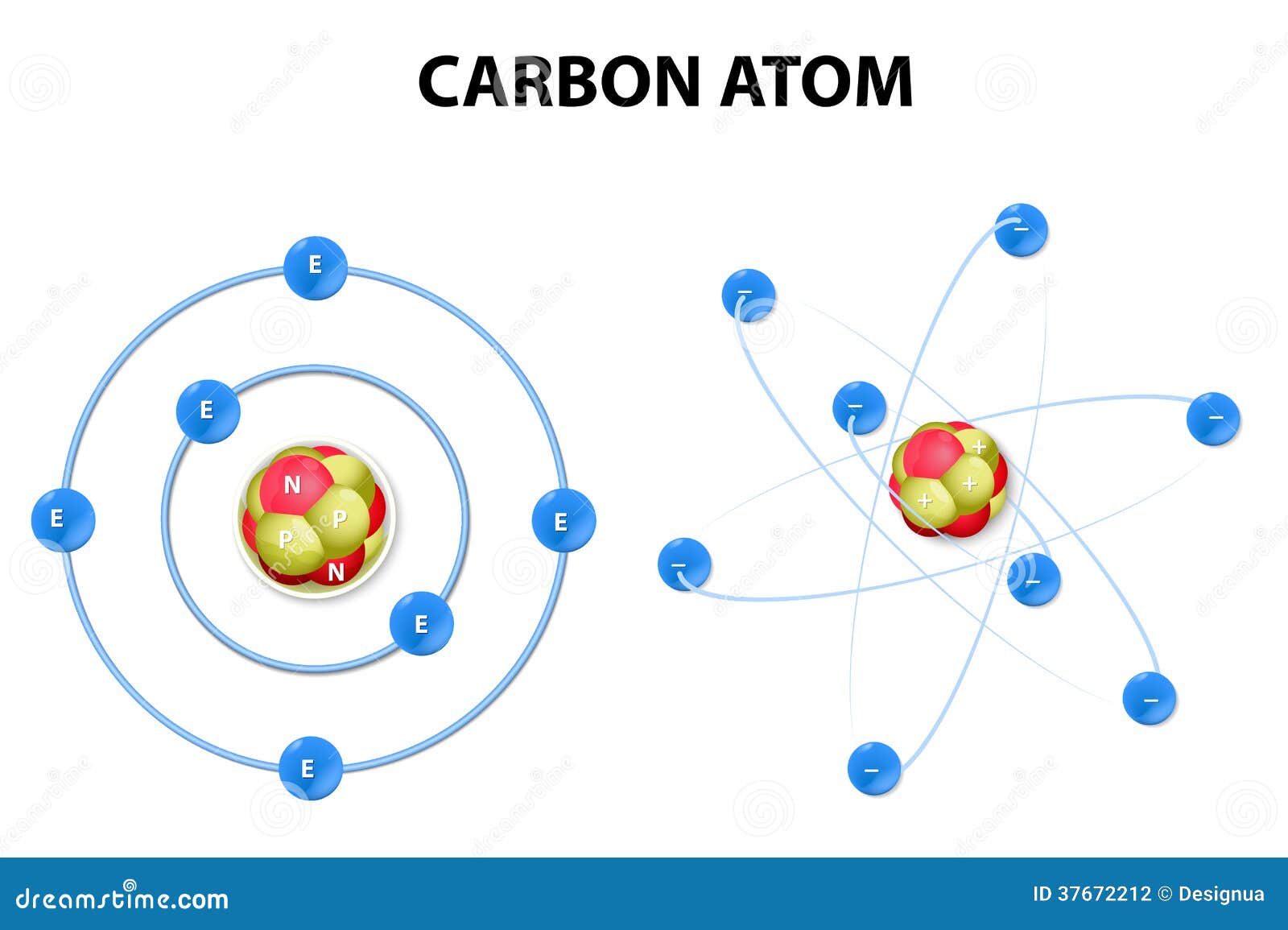
MODELOS ATÓMICOS
MODELOS ATÓMICOS
Modelo atómico de Dalton.
Fue el primer modelo atómico con bases científicas, fue formulado en 1808.
¿En qué consiste?
En su teoría Dalton define la materia como un conjunto de partículas minúsculas,esféricas,indivisibles,inmutables e iguales entre sí en cada elemento químico.
¿Qué conseguía explicar o resolver?
Dalton hizo los siguientes postulados:
1- La materia está compuesta por partículas diminutas, indivisibles e indestructibles llamadas átomos.
2- Los átomos de un mismo elemento son idénticos entre sí, es decir, con igual masa y propiedades.
3- Los átomos de diferentes elementos tienen masas y propiedades distintas.
4- Los átomos permanecen sin división, incluso cuando se combinan en reacciones químicas.
5- Los átomos, al combinarse para formar compuestos( lo que llamamos moléculas) mantienen relaciones simples.
6- Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.
7- Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos. Para Dalton un átomo era algo así como una pequeña esfera.
¿Por qué fue descartado el modelo de Dalton?
El modelo de Dalton fue descartado porque los átomos sí se pueden dividir (partículas subatómicas), no son iguales los átomos de un mismo elemento, y los átomos no solamente son neutros, ya que existen los cationes y aniones.
Este modelo fue descartado ante el modelo atómico de Thomson.


Modelo atómico de Thomson.
Es una teoría sobre la estructura atómica propuesta en 1904.
¿En qué consiste?
Thomson llegó a la conclusión que el átomo debía ser como una gran masa de carga positiva, e insertados en ella, debían estar una partículas negativas a las que llamó electrones, que también tenían masa. La carga negativa de los electrones compensaban la carga positiva para que el átomo fuese neutro. Este modelo es conocido coloquialmente como "budín de pasas".
Demostró que dentro de los átomos hay unas partículas diminutas con carga eléctrica negativa, a las que llamó electrones.
¿Qué conseguía explicar o resolver?
Para comprobar su teoría J.J. Thomson ideó experimentos en tubos de descarga, que se les había extraído prácticamente todo el aire, y que tenían un polo positivo y otro negativo sometidos a una diferencia de potencial grande y se observa que aparecen unos rayos llamados rayos catódicos que como se comprobó son chorros de unas partículas que tenían las siguientes características:
1- Viajan en línea recta.
2- Si se pone un molinillo se mueven las aspas de éste, con lo cual quiere decir que tienen masa.
3- Si se aplica un campo eléctrico, el rayo se desvía hacia la placa positiva, por ello podemos determinar que tienen carga negativa.
A estas partículas se les llamaron electrones.
¿Por qué fue descartado el modelo de Thomson?
El modelo de Thomson fue descartado porque el átomo no es ni macizo ni compacto, como suponía Thomson, es prácticamente hueco y el núcleo es muy pequeño comparado con el tamaño del átomo, según demostró Rutherford, en sus experiencias, por eso el modelo de Thomson ya no fue válido.

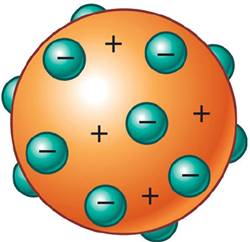
Modelo atómico de Rutherford.
Fue el primer modelo atómico que consideró al átomo formado por dos partes. Su teoría fue propuesta en 1911.
¿En qué consiste?
Dedujo que el átomo debía estar formado por una corteza con los electrones girando alrededor de un núcleo central cargado positivamente.
¿Qué conseguía explicar o resolver?
1- La mayor parte de la masa del átomo y toda su carga positiva están en la zona central minúscula llamada núcleo.
2- En torno al núcleo y a grandes distancias de él están los electrones girando a su alrededor.
3- El número de cargas positivas (+) es el mismo que el de cargas negativas (-), de manera que el átomo es neutro.
¿Por qué fue descartado el modelo de Rutherford?
Este modelo fue descartado, ya que se contradecía con las leyes del electromagnetismo de Maxwell, las cuales estaban ampliamente comprobadas mediante numerosos datos experimentales. Según las leyes de Maxwell, una carga eléctrica en movimiento (como es el electrón) debería emitir energía continuamente en forma de radiación, con lo que llegaría un momento en que el electrón caería sobre el núcleo y la materia se destruiría; esto debería ocurrir en un tiempo muy breve. Tampoco explicaba los espectros atómicos.

Modelo atómico de Bohr.
Fue el primer modelo atómico en el que se introduce una cuantización. Su teoría fue propuesta en 1913.
¿En qué consiste?
Propuso un nuevo modelo atómico, según el cual los electrones giran alrededor del núcleo en unos niveles bien definidos.
¿Qué conseguía explicar o resolver?
1- Los electrones sólo pueden girar en determinadas órbitas circulares( en el modelo de Rutherford los electrones pueden estar girando en órbitas a cualquier distancia del núcleo).
2- Los electrones se organizan en capas que llamamos niveles de energía.
3- Los electrones de un átomo se van situando llenando primero los niveles de menor energía.
¿Por qué fue descartado el modelo de Bohr?
El modelo de Bohr descartado ya que no supo explicar la existancia de órbitas estables y la condición de cuantización. Para los cálculos de Bohr supone que los electrones tienen una masa infinitamente menor que la de los protones cuando solo es 1830 veces menor. También supone que el núcleo es estático cuando se mueve alrededor de un centro de gravedad.


Modelo cuántico actual( modelo de Heisenberg y Schrödinger)
Fue desarrollado durante 1925 sobretodo por Heisenberg y Schrödinger. Es un modelo de gran complejidad matemática, tanta que usándolo sólo se puede resolver con exactitud el átomo de hidrógeno.
¿En qué consiste?
En el modelo actual no existen órbitas bien definidas por las que se mueven los electrones, sino que existen regiones del espacio, denominadas orbitales, en las que es muy probable encontrarlos.
¿Qué conseguía explicar o resolver?
Este modelo se basa en el principio de dualidad onda corpúsculo y en el principio de incertidumbre de Heisenberg y explica que:
1- El electrón se comporta como una onda y como un corpúsculo ( actual onda - corpúsculo)
2- No es posible predecir la trayectoria del electrón( principio de la incertidumbre de Heisenberg). Hay que abandonar la idea de órbita y hablar de orbitales que son las zonas donde es más probable encontrar al electrón).
3- En cada orbital no puede haber más de dos electrones.
4- Hay varias clases de orbitales que se diferencian en su forma y orientación (s, p, d, f).
5- En cada nivel hay un número determinado de orbitales.


martes, 18 de octubre de 2016
PROYECTO DE INVESTIGACIÓN.
PROYECTO DE INVESTIGACIÓN
Voy a realizar mi proyecto de investigación sobre la energía oscura.
Suscribirse a:
Entradas (Atom)
