MODELOS ATÓMICOS
Modelo atómico de Dalton.
Fue el primer modelo atómico con bases científicas, fue formulado en 1808.
¿En qué consiste?
En su teoría Dalton define la materia como un conjunto de partículas minúsculas,esféricas,indivisibles,inmutables e iguales entre sí en cada elemento químico.
¿Qué conseguía explicar o resolver?
Dalton hizo los siguientes postulados:
1- La materia está compuesta por partículas diminutas, indivisibles e indestructibles llamadas átomos.
2- Los átomos de un mismo elemento son idénticos entre sí, es decir, con igual masa y propiedades.
3- Los átomos de diferentes elementos tienen masas y propiedades distintas.
4- Los átomos permanecen sin división, incluso cuando se combinan en reacciones químicas.
5- Los átomos, al combinarse para formar compuestos( lo que llamamos moléculas) mantienen relaciones simples.
6- Los átomos de elementos diferentes se pueden combinar en proporciones distintas y formar más de un compuesto.
7- Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos. Para Dalton un átomo era algo así como una pequeña esfera.
¿Por qué fue descartado el modelo de Dalton?
El modelo de Dalton fue descartado porque los átomos sí se pueden dividir (partículas subatómicas), no son iguales los átomos de un mismo elemento, y los átomos no solamente son neutros, ya que existen los cationes y aniones.
Este modelo fue descartado ante el modelo atómico de Thomson.


Modelo atómico de Thomson.
Es una teoría sobre la estructura atómica propuesta en 1904.
¿En qué consiste?
Thomson llegó a la conclusión que el átomo debía ser como una gran masa de carga positiva, e insertados en ella, debían estar una partículas negativas a las que llamó electrones, que también tenían masa. La carga negativa de los electrones compensaban la carga positiva para que el átomo fuese neutro. Este modelo es conocido coloquialmente como "budín de pasas".
Demostró que dentro de los átomos hay unas partículas diminutas con carga eléctrica negativa, a las que llamó electrones.
¿Qué conseguía explicar o resolver?
Para comprobar su teoría J.J. Thomson ideó experimentos en tubos de descarga, que se les había extraído prácticamente todo el aire, y que tenían un polo positivo y otro negativo sometidos a una diferencia de potencial grande y se observa que aparecen unos rayos llamados rayos catódicos que como se comprobó son chorros de unas partículas que tenían las siguientes características:
1- Viajan en línea recta.
2- Si se pone un molinillo se mueven las aspas de éste, con lo cual quiere decir que tienen masa.
3- Si se aplica un campo eléctrico, el rayo se desvía hacia la placa positiva, por ello podemos determinar que tienen carga negativa.
A estas partículas se les llamaron electrones.
¿Por qué fue descartado el modelo de Thomson?
El modelo de Thomson fue descartado porque el átomo no es ni macizo ni compacto, como suponía Thomson, es prácticamente hueco y el núcleo es muy pequeño comparado con el tamaño del átomo, según demostró Rutherford, en sus experiencias, por eso el modelo de Thomson ya no fue válido.

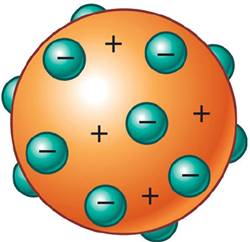
Modelo atómico de Rutherford.
Fue el primer modelo atómico que consideró al átomo formado por dos partes. Su teoría fue propuesta en 1911.
¿En qué consiste?
Dedujo que el átomo debía estar formado por una corteza con los electrones girando alrededor de un núcleo central cargado positivamente.
¿Qué conseguía explicar o resolver?
1- La mayor parte de la masa del átomo y toda su carga positiva están en la zona central minúscula llamada núcleo.
2- En torno al núcleo y a grandes distancias de él están los electrones girando a su alrededor.
3- El número de cargas positivas (+) es el mismo que el de cargas negativas (-), de manera que el átomo es neutro.
¿Por qué fue descartado el modelo de Rutherford?
Este modelo fue descartado, ya que se contradecía con las leyes del electromagnetismo de Maxwell, las cuales estaban ampliamente comprobadas mediante numerosos datos experimentales. Según las leyes de Maxwell, una carga eléctrica en movimiento (como es el electrón) debería emitir energía continuamente en forma de radiación, con lo que llegaría un momento en que el electrón caería sobre el núcleo y la materia se destruiría; esto debería ocurrir en un tiempo muy breve. Tampoco explicaba los espectros atómicos.

Modelo atómico de Bohr.
Fue el primer modelo atómico en el que se introduce una cuantización. Su teoría fue propuesta en 1913.
¿En qué consiste?
Propuso un nuevo modelo atómico, según el cual los electrones giran alrededor del núcleo en unos niveles bien definidos.
¿Qué conseguía explicar o resolver?
1- Los electrones sólo pueden girar en determinadas órbitas circulares( en el modelo de Rutherford los electrones pueden estar girando en órbitas a cualquier distancia del núcleo).
2- Los electrones se organizan en capas que llamamos niveles de energía.
3- Los electrones de un átomo se van situando llenando primero los niveles de menor energía.
¿Por qué fue descartado el modelo de Bohr?
El modelo de Bohr descartado ya que no supo explicar la existancia de órbitas estables y la condición de cuantización. Para los cálculos de Bohr supone que los electrones tienen una masa infinitamente menor que la de los protones cuando solo es 1830 veces menor. También supone que el núcleo es estático cuando se mueve alrededor de un centro de gravedad.


Modelo cuántico actual( modelo de Heisenberg y Schrödinger)
Fue desarrollado durante 1925 sobretodo por Heisenberg y Schrödinger. Es un modelo de gran complejidad matemática, tanta que usándolo sólo se puede resolver con exactitud el átomo de hidrógeno.
¿En qué consiste?
En el modelo actual no existen órbitas bien definidas por las que se mueven los electrones, sino que existen regiones del espacio, denominadas orbitales, en las que es muy probable encontrarlos.
¿Qué conseguía explicar o resolver?
Este modelo se basa en el principio de dualidad onda corpúsculo y en el principio de incertidumbre de Heisenberg y explica que:
1- El electrón se comporta como una onda y como un corpúsculo ( actual onda - corpúsculo)
2- No es posible predecir la trayectoria del electrón( principio de la incertidumbre de Heisenberg). Hay que abandonar la idea de órbita y hablar de orbitales que son las zonas donde es más probable encontrar al electrón).
3- En cada orbital no puede haber más de dos electrones.
4- Hay varias clases de orbitales que se diferencian en su forma y orientación (s, p, d, f).
5- En cada nivel hay un número determinado de orbitales.


muy bien chico
ResponderEliminarEsta tot molt clar i molt ben expicat
ResponderEliminardilo en español gilipollas
Eliminary a ti q mas te da en q lo diga gilpollas
Eliminar